안녕하세요 벨카입니다. 미국 에이치엘비(HLB)의 자회사이자 전세계 판권을 보유한 엘레바가 바이오유럽스프링에 참석해 리보세라닙의 간암 1차 치료제 유럽 허가 신청을 마친 뒤 상용화 준비에 들어간 것으로 알려졌다.
에이치엘비(HLB)
미국 자회사 엘레바, 유럽 진출 준비
유기농 유럽 봄

먼저 지난 3월 20일부터 22일까지 스위스 바젤에서 유럽 최대의 유기농 컨퍼런스인 ‘Bio-Europe Spring’이 열렸다. 노바티스, 로슈, 화이자 등 다국적 글로벌 제약사들이 대거 참석했으며, 이 행사는 매년 참석해 협업 기회를 논의한다.
에이치엘비(HLB) 자회사 엘레바 참여

엘레바는 간암 1차 치료제인 리보세라닙의 글로벌 임상 3상을 완료했으며, 2023년 5월 미국 식품의약국(FDA)에 신약 허가 신청을 준비 중이다. 이들은 미국에서 신약을 신청한 직후 유럽 등 주요 시장에 대한 허가 절차를 진행할 예정인 만큼 다국적 제약사와 파트너십을 논의할 계획인 것으로 전해졌다.
에이치엘비(HL) 리보세라닙의 상용화 전략에 대해서는 미국 직판과 유럽 협력 판매를 검토 중이며 빠른 시장 선점을 위한 유통망 확보를 위한 협상을 진행할 예정이다.
리보세라닙이란?
리보세라닙은 중국에서 위암에 대해 승인된 최초의 소분자 티로신 키나아제 억제제(TKI)입니다(2014년 11월). 리보세라닙은 종양 혈관신생의 주요 경로인 혈관 내피 성장 인자 수용체 2(VEGFR-2)의 매우 강력한 억제제로 알려져 있습니다. VEGFR-2 억제는 종양 성장 및 질병 진행을 제한하는 임상적으로 검증된 접근법입니다. Rivoceranib은 중국의 Hengrui Pharma와 전 세계의 Elevar Therapeutics, Inc.(중국 제외)가 공동으로 개발했습니다.
전 세계적으로 6,000명 이상의 환자를 대상으로 연구되었으며 다른 TKI 및 VEGF 억제제와 비슷한 안전성 프로파일로 임상 시험에서 내약성이 우수했습니다. 리보세라닙은 현재 다양한 고형 종양 적응증(®)에서 단일 요법 및 화학 요법 및 면역 요법과의 병용 요법으로 연구되고 있습니다. 위암(미국, EU 및 한국), 선양 낭성 암종(미국) 및 HCC(미국)에 대해 희귀 의약품 지정이 승인되었습니다. Elevar는 글로벌 권리(중국 제외)를 보유하고 있으며 한국에서 HLB-LS 및 Rivoceranib의 개발 및 상용화 파트너입니다. Apatinib이라고 하는 Rivoceranib은 현재 진행성 위암 및 이차 진행성 간세포암종의 치료를 위해 중국 영토 라이선스 보유자 Hengrui Pharma에 의해 Aitan이라는 브랜드 이름으로 중국에서 승인되었습니다.
HLB(HLB) 분석

에이치엘비, 엘레바, 이뮤노믹은 다양한 신약(항암제, 면역항암제 등) 개발 및 임상시험 경험을 보유한 글로벌 바이오 제약회사입니다.
에이치엘비의 에이치엘비 헬스케어 사업부는 체외진단제 및 의약외품을 제조, 판매하고 있으며, 에이치엘비 이엔지 사업부는 구명보트 및 데빗, 특수선, GRP/GRE PIPES를 제조, 판매하고 있습니다.
에이치엘비(HLB) 판매
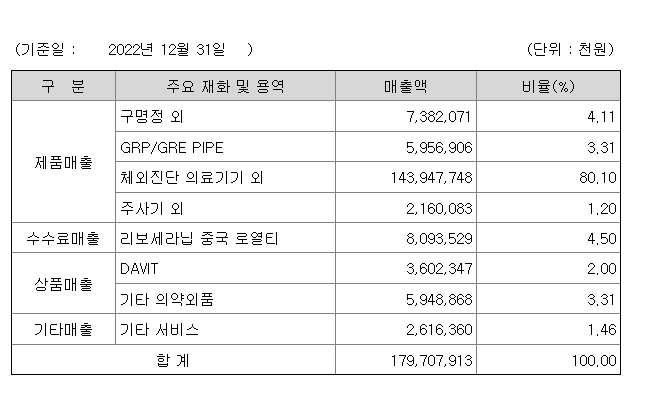
제품 판매 내역을 살펴보면 판매의 대부분인 약 80%가 비 IVD 의료기기에서 발생하고 있음을 알 수 있습니다. 현재 리보세라닙의 중국 로열티율은 약 4.5% 수준이다.
에이치엘비(HLB) 재무제표
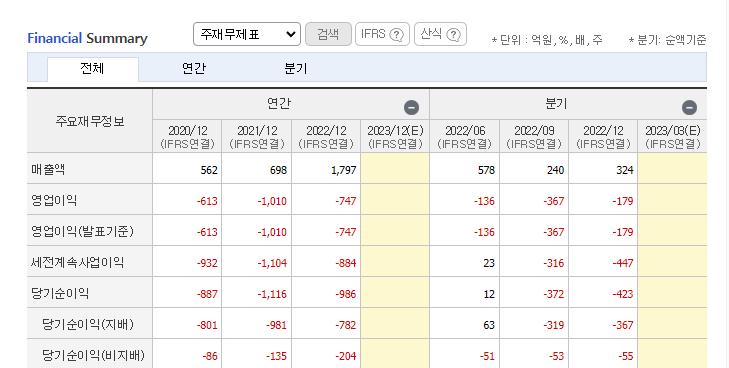
연말 실적을 보면 2022년 매출은 157%, 영업이익은 26%, 당기순이익은 16.7% 증가했다. 그건 헬스케어 사업(구 FA) 합병으로 유기적 사업 매출이 증가했고, 투자주 평가이익으로 당기순이익이 증가했다.
도표
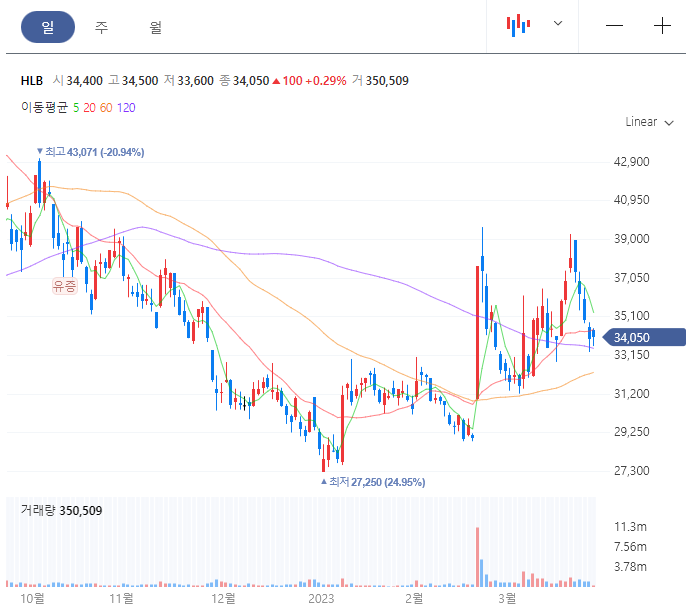
일봉차트를 보면 거래량과 함께 바닥에서 나오는 장대양봉으로 추세전환 시도를 보이고 있습니다. 근데 지금 더블바 조절하는 중인데 아직 파동의 고점을 돌파하지 않은 만큼 상승세는 계속될 것으로 보인다.
이상으로 포스팅을 마치겠습니다.
